Продолжение. См. № 4, 6, 8, 10/05
4 Через
кран, вмонтированный в дно горизонтального
цилиндра (рис. 2), закачали некоторое количество
гелия. При этом поршень в цилиндре перемещался,
преодолевая действие внешнего атмосферного
давления р0 и силу сухого трения о
стенки цилиндра. Затем кран закрыли и
температуру газа изменили так, что его объём
установился равным V0. Какое
количество теплоты Q нужно после этого
сообщить газу, чтобы расстояние между дном
цилиндра и поршнем увеличилось на ![]() L? Площадь
сечения поршня равна S, величина силы сухого
трения скольжения равна Fтр. Ускорение
свободного падения равно g.
L? Площадь
сечения поршня равна S, величина силы сухого
трения скольжения равна Fтр. Ускорение
свободного падения равно g.
![]()
Рис. 2
Решение
При решении задачи будем предполагать, что цилиндр покоится относительно лабораторной системы отсчёта и эту систему можно считать инерциальной. Кроме того, будем считать, что изменение температуры гелия происходит так, что поршень перемещается очень медленно и давление во всех точках внутри цилиндра изменяется одинаковым образом. При выполнении этих условий, если гелий после закачки охлаждали (первый случай), то его объём мог только уменьшаться, а поршень мог двигаться к дну цилиндра, преодолевая силу сухого трения. Следовательно, в этом случае давление гелия в цилиндре перед нагреванием не могло быть меньше p1=p0–Fтр/S. Если же газ предварительно нагревали (второй случай), то направление силы сухого трения, действующей на поршень, совпадало с направлением силы атмосферного давления, а потому давление в цилиндре все время оставалось равным p2=p0+Fтр/S.
Из сказанного ясно, что в первом случае объём гелия при нагревании не будет изменяться, пока его давление не станет равным р2. Во втором же случае объём гелия должен начать увеличиваться сразу, как только его стали нагревать, причём давление гелия будет оставаться неизменным и равным р2.
Пусть абсолютная температура гелия
при давлении р1 и объёме V0
равна Т2, а при увеличении объёма гелия
на величину S![]() L должна стать равной Т3.
Полагая, что количество гелия
L должна стать равной Т3.
Полагая, что количество гелия ![]() в цилиндре неизменно и в
интересующем диапазоне температур и давлений
гелий подчиняется уравнению
Клапейрона–Менделеева, можно утверждать, что
указанные температуры должны удовлетворять
соотношениям:
в цилиндре неизменно и в
интересующем диапазоне температур и давлений
гелий подчиняется уравнению
Клапейрона–Менделеева, можно утверждать, что
указанные температуры должны удовлетворять
соотношениям:
![]()
![]()
![]()
где R – универсальная газовая постоянная.
Как известно, гелий является инертным
газом. Поэтому внутренняя энергия гелия при
температуре Т (как и любого идеального
одноатомного газа) равна 1,5![]() RT. Поскольку в первом
случае гелий надо нагревать от температуры не
меньше Т1 до температуры Т2
изохорически, то подводимое к нему количество
теплоты при выполнении сделанных выше
предположений будет увеличивать только его
внутреннюю энергию. Поэтому для такого
нагревания потребуется количество теплоты, не
превышающее
RT. Поскольку в первом
случае гелий надо нагревать от температуры не
меньше Т1 до температуры Т2
изохорически, то подводимое к нему количество
теплоты при выполнении сделанных выше
предположений будет увеличивать только его
внутреннюю энергию. Поэтому для такого
нагревания потребуется количество теплоты, не
превышающее
![]()
Нагревание же гелия от температуры Т2 до температуры Т3 будет происходить изобарически. Следовательно, будет увеличиваться внутренняя энергия гелия, при этом он ещё будет совершать работу над поршнем. Поэтому, согласно первому началу термодинамики, молярную теплоёмкость гелия при таком нагревании следует считать равной 2,5R, а потому для нагревания гелия от температуры Т2 до температуры Т3 необходимо количество теплоты, равное
![]()
Решая совместно приведённые уравнения, можно показать, что
![]() а
а ![]()
Следовательно, искомое количество теплоты Q в зависимости от того, каким образом объём гелия после закачки его в цилиндр был сделан равным V0, должно удовлетворять неравенству:
![]()
5 Между
дном горизонтального цилиндра и гладким поршнем
при температуре T1 = 111 К содержится
смесь гелия и криптона. Относительная влажность
криптона r=0,5. Плотность гелия в n=2 раза
меньше плотности криптона. Вне цилиндра давление
равно нормальному атмосферному. Температура
кипения криптона при нормальном атмосферном
давлении Tк![]() 121 К. На сколько нужно понизить
температуру смеси, чтобы на стенках цилиндра
выпала роса? Молярные массы гелия и криптона
121 К. На сколько нужно понизить
температуру смеси, чтобы на стенках цилиндра
выпала роса? Молярные массы гелия и криптона ![]() г = 4 г/моль и
г = 4 г/моль и ![]() к
к ![]() 84 г/моль. Считать, что
давление насыщенных паров криптона линейно
зависит от его абсолютной температуры.
84 г/моль. Считать, что
давление насыщенных паров криптона линейно
зависит от его абсолютной температуры.
Решение
При решении задачи будем, как обычно,
считать, что поведение гелия и криптона вплоть до
точки насыщения подчиняется уравнению
Клапейрона–Менделеева, а охлаждение смеси
происходит столь медленно, что содержимое
цилиндра всё время находится в состоянии
термодинамического равновесия. Кроме того, будем
считать, что в цилиндре существуют такие условия,
при которых криптон начинает конденсироваться,
как только его парциальное давление становится
равным давлению pнк его насыщенных паров.
Отметим, что, поскольку криптон в газообразном
состоянии в цилиндре находится при температуре
явно ниже критической (Tкрк![]() 210 К), его следует
называть паром, в то время как гелий (Tкрг
210 К), его следует
называть паром, в то время как гелий (Tкрг![]() 5 К) следует
называть газом.
5 К) следует
называть газом.
При соблюдении указанных выше
предположений, согласно уравнению
Клапейрона–Менделеева, плотность ![]() i компоненты смеси,
находящейся в газообразном состоянии, её
молярная масса
i компоненты смеси,
находящейся в газообразном состоянии, её
молярная масса ![]() i, абсолютная температура Ti и
парциальное давление рi должны
удовлетворять уравнению
i, абсолютная температура Ti и
парциальное давление рi должны
удовлетворять уравнению
![]()
где R – универсальная газовая
постоянная, если ![]() Следовательно,
Следовательно,
![]()
Поскольку, по условию задачи, поршень гладкий, а ось цилиндра расположена горизонтально, то, считая, как обычно, цилиндр покоящимся относительно некоторой инерциальной системы отсчёта, при выполнении указанных выше предположений можно утверждать, что сумма парциальных давлений гелия и криптона при любой температуре равна внешнему атмосферному давлению р, а потому парциальное давление криптона
![]()
т.е. не зависит от температуры при ![]() где Т2
– абсолютная температура, при которой пары
криптона становятся насыщенными.
где Т2
– абсолютная температура, при которой пары
криптона становятся насыщенными.
По условию задачи, относительная влажность газопаровой смеси при температуре Т1 равна r, криптон при нормальном атмосферном давлении кипит при температуре Тк, а потому должны выполняться соотношения:
pк(T1) = rpкн(T1); pкн(Tк) = p и pк(T2) = pкн(T2),
причем, по условию задачи,
pкн(Ti) = a + bTi.
Решая совместно приведённые уравнения, получаем
![]()
Следовательно, на стенках цилиндра должна появиться роса, если температуру смеси понизить на
![]()
6 На рис. 3
показана зависимость объёма V от абсолютной
температуры Т одного моля гелия,
используемого в качестве рабочего вещества в
тепловом двигателе. Температура Т гелия во
время этого цикла изменяется в ![]() = 9 раз. Первый участок
диаграммы – отрезок прямой, проходящей через
начало координат, на втором участке объём гелия
постоянен, а на третьем участке объём изменяется
пропорционально
= 9 раз. Первый участок
диаграммы – отрезок прямой, проходящей через
начало координат, на втором участке объём гелия
постоянен, а на третьем участке объём изменяется
пропорционально ![]() Найдите КПД двигателя.
Найдите КПД двигателя.
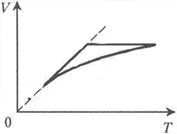
Рис. 3
Решение
Согласно условию задачи, температура во всех точках занимаемого газом объёма изменяется одинаково, т.к. в противном случае цикл было бы невозможно изобразить на V, T-диаграмме. Поэтому можно утверждать, что изменение параметров гелия во время цикла осуществляется квазиравновесно, а потому давление газа во всех точках занимаемого им объёма должно быть одинаковым и изменяться одновременно. Как обычно это и делается при решении подобных задач, будем считать, что давление p одного моля гелия при квазиравновесном изменении его объёма V и абсолютной температуры Т изменяется в соответствии с уравнением состояния идеального газа, т.е. p=RT/V, где R – универсальная газовая постоянная. Следовательно, на первом участке цикла давление гелия, как и его объём на втором участке, остаётся неизменным, а на третьем участке давление изменяется прямо пропорционально объёму газа. В соответствии со сказанным на рис. 4 заданный цикл теплового двигателя изображён на p, V-диаграмме. Здесь точкой 1 обозначено состояние газа с минимальной, а точкой 2 – с максимальной температурами. При указании стрелками направления обхода контура цикла было учтено, что работа газа за цикл должна быть положительной, т.к. это цикл теплового двигателя, т.е. устройства, преобразующего тепловую энергию в механическую.
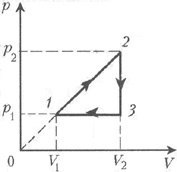
Рис. 4
Из приведённой диаграммы видно, что на участке 1–2 газ совершает работу, его температура увеличивается от минимальной Т1 до максимальной Т2. На участке 2–3 температура газа падает до величины Т3, и газ не совершает работы. На последнем участке 3–1 цикла температура, продолжая уменьшаться, возвращается к первоначальной Т1, а газ изобарически сжимают. Поскольку в условии задачи специально не оговаривается, что механическая энергия центра масс газа относительно инерциального наблюдателя изменяется, будем считать её неизменной. Тогда, согласно закону сохранения энергии, должен выполняться первый закон термодинамики, а потому можно утверждать, что газ получает теплоту от нагревателя только на первом участке, а отдаёт теплоту холодильнику на двух последних.
Как известно, внутренняя энергия моля идеального одноатомного газа при абсолютной температуре Т равна 1,5RT. Следовательно, для изменения своей внутренней энергии на участке 1–2 моль гелия должен получить от нагревателя количество теплоты
![]()
а на участках 2–3 и 3–1 отдать холодильнику соответственно количества теплоты
![]() и
и ![]()
Для вычисления работы газа на первом и
третьем участках следует учесть, что при
квазиравновесных процессах силы, действующие на
стенки, ограничивающие объём газа,
перпендикулярны стенкам, т.к. газ обладает
свойством текучести. Поэтому работа газа при
увеличении его объёма на величину ![]() V при
постоянном давлении р равна
V при
постоянном давлении р равна ![]() A = p
A = p![]() V. Отсюда
следует, что при любом квазиравновесном процессе
работа газа при его расширении определяется
площадью фигуры на p, V-диаграмме,
ограниченной графиком p(V), осью V и
перпендикулярами, восставленными к этой оси в
точках, соответствующих началу и концу процесса.
Поскольку площадь трапеции равна половине
произведения суммы длин оснований на длину
высоты трапеции, а площадь прямоугольника равна
произведению длин двух его соседних сторон, то на
участке 1–2 газ совершает работу
V. Отсюда
следует, что при любом квазиравновесном процессе
работа газа при его расширении определяется
площадью фигуры на p, V-диаграмме,
ограниченной графиком p(V), осью V и
перпендикулярами, восставленными к этой оси в
точках, соответствующих началу и концу процесса.
Поскольку площадь трапеции равна половине
произведения суммы длин оснований на длину
высоты трапеции, а площадь прямоугольника равна
произведению длин двух его соседних сторон, то на
участке 1–2 газ совершает работу
A1 = 0,5(p1 + p2)(V2 – V1),
а на участке 3–1 совершённая над газом работа равна
A3 = p1(V2 – V1).
Следовательно, при выполнении сделанных предположений количество теплоты, получаемое гелием от нагревателя за цикл, равно
Qн = 1,5R(T2 – T1) + A1,
а отдаваемое холодильнику
Qx = Q2in + Q3in + A3.
По условию задачи, p1/V1 = p2/V2 (cм. рис. 4). Поскольку, как было предположено выше, piVi = RTi, то
![]()
а потому
Qн = 2(T2 – T1)R;
![]()
По определению, КПД цикла теплового
двигателя ![]() ц
равен отношению работы, совершённой рабочим
веществом за цикл, к полученной этим веществом за
то же время энергии. Поскольку механическая
энергия центра масс газа, по сделанному выше
предположению, остаётся неизменной, то, согласно
закону сохранения энергии, можно утверждать, что
ц
равен отношению работы, совершённой рабочим
веществом за цикл, к полученной этим веществом за
то же время энергии. Поскольку механическая
энергия центра масс газа, по сделанному выше
предположению, остаётся неизменной, то, согласно
закону сохранения энергии, можно утверждать, что
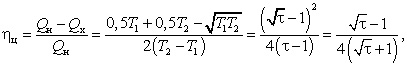
т.к., по условию задачи, T2/T1
= ![]() .
Учитывая, что КПД двигателя не может превышать
КПД цикла рабочего вещества этого двигателя,
получаем, что при выполнении сделанных при
решении задачи предположений искомый КПД
двигателя
.
Учитывая, что КПД двигателя не может превышать
КПД цикла рабочего вещества этого двигателя,
получаем, что при выполнении сделанных при
решении задачи предположений искомый КПД
двигателя
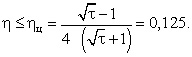
7 Моль гелия в тепловом двигателе совершает цикл, в котором концентрация газа n изменяется с абсолютной температурой Т так, как показано на рис. 5. На участке 3–1 концентрация газа изменяется обратно пропорционально его температуре. Зная, что в этом цикле модули работ газа на участках 3–1 и 2–3 отличаются друг от друга в m раз, найдите КПД цикла.
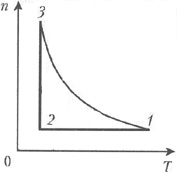
Решение
Согласно приведённому в условии задачи графику зависимости n(T), температура гелия во всех точках рабочего объёма изменяется одинаковым образом, а потому можно считать, что в каждый момент времени имеет место состояние термодинамического равновесия во всем объёме, занятом гелием. При решении задачи будем предполагать, что поведение гелия в данном цикле подобно поведению идеального газа. Как известно, гелий является инертным газом. Поэтому его структурной единицей является атом, а внутренняя энергия одного моля гелия, как и любого идеального одноатомного газа, равна 1,5RT, где R – универсальная газовая постоянная, а Т – абсолютная температура. Кроме того, будем считать, что механическая энергия центра масс гелия относительно инерциального наблюдателя остаётся неизменной, а потому, согласно закону сохранения энергии, должен выполняться первый закон термодинамики.
По условию задачи, количество гелия во
время цикла остаётся неизменным и равным одному
молю. На участке 1–2 концентрация гелия
постоянна. Следовательно, постоянным должен
оставаться и объём V гелия, т.е. при переходе
из точки 1 в точку 2 гелий изохорически охлаждают.
Поскольку, как было уже отмечено выше, процесс
протекает квазиравновесно, то на этом участке
гелий работы не совершает и отдаёт холодильнику
количество теплоты, равное Qx1=1,5RT,
где ![]() T
– уменьшение температуры гелия на этом участке
цикла.
T
– уменьшение температуры гелия на этом участке
цикла.
На участке 2–3 гелий изотермически сжимают, т.к. концентрация гелия увеличивается при переходе из точки 2 в точку 3. Следовательно, над гелием производят некоторую работу А23. При этом кинетическая энергия теплового движения гелия остаётся неизменной, т.к. его температура остаётся постоянной. Поскольку гелий описывается моделью идеального газа, на этом участке цикла внутренняя энергия гелия остаётся неизменной, и он, согласно первому закону термодинамики, отдаёт холодильнику количество теплоты Qx2 = А23.
На участке 3–1 концентрация гелия, по
условию задачи, изменяется обратно
пропорционально его температуре. Поскольку
концентрация неизменного количества гелия
обратно пропорциональна его объёму, то, согласно
уравнению Клапейрона–Менделеева, давление р
гелия на этом участке остаётся постоянным. Точки
3 и 2 лежат на одной изотерме. Следовательно,
приращение температуры гелия при переходе из
точки 3 в точку 1 равно ![]() T. Таким образом, на этом
участке цикла гелий расширяется изобарически и
сам совершает работу A31=p
T. Таким образом, на этом
участке цикла гелий расширяется изобарически и
сам совершает работу A31=p![]() V=R
V=R![]() T,
где
T,
где ![]() V
– приращение объёма гелия. При этом гелий должен
получить от нагревателя количество теплоты Qн
= 2,5 R
V
– приращение объёма гелия. При этом гелий должен
получить от нагревателя количество теплоты Qн
= 2,5 R![]() T,
т.к. молярная теплоёмкость идеального
одноатомного газа при изобарическом нагревании
равна 2,5 R.
T,
т.к. молярная теплоёмкость идеального
одноатомного газа при изобарическом нагревании
равна 2,5 R.
По условию задачи, заданный цикл является циклом теплового двигателя. Поэтому совершённая рабочим веществом двигателя работа за цикл должна быть больше работы, совершённой над этим веществом. Следовательно, если считать, что заданное в условии задачи число m больше единицы, то должно выполняться равенство A31=mA23.
Из сказанного следует, что гелий за
цикл совершает работу A=A31–A23=
(1– m–1)R![]() T, получая при этом от
нагревателя количество теплоты Qн.
Поскольку КПД цикла равен отношению полезной
работы рабочего вещества за цикл к количеству
теплоты, полученному им от нагревателя за то же
время, то искомый КПД равен
T, получая при этом от
нагревателя количество теплоты Qн.
Поскольку КПД цикла равен отношению полезной
работы рабочего вещества за цикл к количеству
теплоты, полученному им от нагревателя за то же
время, то искомый КПД равен ![]() = 0,4(1–m–1), если
считать, что m>1.
= 0,4(1–m–1), если
считать, что m>1.