Заказная статьяА.А.КНЯЗЕВ,Лицей прикладных наук, г. Саратов knf@sgu.ru Диффузия или конвекция? Довольно часто явления диффузии и конвекции проявляются совместно, но оба рассмотрены в учебниках разве что качественно, поэтому школьники затрудняются с чёткими ответами по существу.
1. Диффузия. Для любителей
программирования программа, демонстрирующая
тепловое движение одной молекулы из облака газа,
может являться одним из первых критериев
зрелости. Она довольно проста в математическом
плане, да и графическое исполнение
непритязательно – в самый раз для небольшой
симпатичной работы. На рисунке – фрагменты
работы одной из таких программ студента первого
курса факультета нелинейных процессов СГУ Сергея
Садовникова (2004 г.). Видно, как частица блуждает
от столкновения до столкновения и каждый раз
произвольно изменяет направление. На первых
шагах возникает впечатление, что частица
движется в каком-то определённом направлении
(фрагмент 1). Скоро становится ясно, что это просто
случайные блуждания вокруг исходной точки,
установленной в центре поля (фрагмент 2). Со
временем захватываемая движением область
разрастается в размерах (фрагменты 3 и 4). И так
движется каждая частица, сколько бы их ни было.
Именно этот сценарий не поддавался описанию
более восьмидесяти лет со времени Р.Броуна* (1826).
(*Можно сослаться и на Лукреция Кара, где он
отмечает пляску пылинок в луче солнца и
совершенно верно высказывается о первопричинах
явления. Однако подобные обращения к древним
грекам или к древним китайцам, которые знали всё,
на мой взгляд, банальны – от гипотез до
плодотворной теории огромная дистанция.) Только
в 1905 г. появилась простая формула, описывающая
рост со временем радиуса области, охваченной
хаотическим блужданием частицы:
потому что из-за случайности
выбора угла на каждом последующем шаге Если не вдаваться в
подробности молекулярно-кинетической теории,
коэффициент диффузии для газов определяется
довольно простой формулой: Напомним, что для конкретных
вычислений более удобно другое представление
этой, последней, формулы, связанное не с массой
одиночной молекулы, а с молярной массой: Это означает, что для
распространения запаха, например, спирта (духов,
одеколона) на расстояние 4–5 м за счёт только
диффузии понадобится время порядка 2. Конвекция. Физическая суть явления состоит, как известно, в том, что тёплый воздух имеет меньшую плотность, чем охлаждённый, потому любой местный нагрев вызывает процесс дополнительной циркуляции диффундирующего облака частиц. В комнате, например, более холодными являются наружные стены, углы, окна, вентиляционные решётки и т.п. (см. фото). Скорость конвективного движения можно оценить, решив известную задаче о сигаретном дыме*. (*Сигарета, конечно, вовсе не обязательна, так же ведёт себя дым из печной трубы или из выхлопной трубы автомобиля. Примеры строгого решения задач с использованием дифференциальных уравнений имеются для конкретных симметричных конфигураций в институтских учебниках по теплотехнике.)
Решение Будем считать, что движение выбранной массы газа происходит с постоянным ускорением а, которое определяется силой Архимеда. Тогда для элементарного объёма газа запишем уравнение движения:
где в скобках – разность плотностей горячего и холодного воздуха, V – объём. Отсюда получаем
Теперь оценим значение
скорости: 3. Так всё же диффузия или конвекция? Этот пример полезен методикой оценки. В нашем случае перепад плотности меньше, чем в примере с сигаретой. При перепаде температур от 20 °С до 30 °С получаем ускорение a = 0,03g, тогда скорость движения на таком же участке пути оказывается примерно в три раза меньше. По этой новой оценке, чтобы почувствовать запах духов в комнате, нужно около одной минуты – это реально. Для более точного прогноза скорости конвекции нужны уже многочисленные конкретные данные. Скажем только, что ускорение не может поддерживаться постоянным на большом расстоянии из-за развития неустойчивостей. Поток начинает «клубиться», как дым от сигареты, и далее скорость не растёт. Поскольку скорость конвекции на порядки превышает скорость диффузии, то явление распространения запаха по комнате вполне логично объяснять действием именно конвекции. Диффузия, безусловно, участвует в процессе, но не определяет масштаба скорости. А показать «чистую» диффузию довольно сложно.
Приведённую формулу легко
получить. Массу жидкости, вылетевшей за малый
промежуток времени Приравнивая два выражения для масс, получим уравнение, описывающее элементарное смещение границы жидкости влево (см. рисунок) за счёт диффузионного ухода частиц жидкости вправо:
Суммируя за конечное время
наблюдения, получаем Литература Бабичев А.П. и др. Физические величины: Справочник. Под ред. Григорьева И.С., Мейлихова Е.З. – М.: Энергоатомиздат, 1991. Жуков А.Г., Горюнов А.Н., Кальфа А.А. Тепловизионные приборы и их применение. – М.: Радио и связь, 1983. Матвеев А.Н. Молекулярная физика: Уч. пособие для вузов. – М.: Высшая школа, 1981. _______________________________ Работа выполнена по нашему заказу. – Ред. |

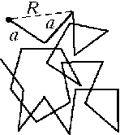 Пусть частица делает
последовательные шаги ri одинаковой
длины a. Измерим расстояние R между
начальной точкой и положением частицы через n
шагов. Для среднего квадрата расстояния можно
записать:
Пусть частица делает
последовательные шаги ri одинаковой
длины a. Измерим расстояние R между
начальной точкой и положением частицы через n
шагов. Для среднего квадрата расстояния можно
записать: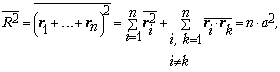

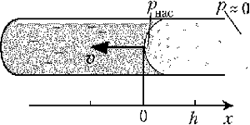 В одном из методов
предлагают наблюдать за процессом испарения
жидкости из частично заполненного капилляра, где
конвективные потоки могут быть пренебрежимо
малы. Удобно использовать одноразовый шприц, в
который вместо иглы вставлен стеклянный
капилляр (например, от градусника). Наблюдать за
перемещающейся границей раздела жидкости и
насыщенного пара удобно в микроскоп с небольшим
увеличением. Для демонстрации в аудитории
наиболее удобна видеокамера. Измеряя скорость
перемещения границы, можно измерить коэффициент
диффузии по следующей рабочей формуле:
В одном из методов
предлагают наблюдать за процессом испарения
жидкости из частично заполненного капилляра, где
конвективные потоки могут быть пренебрежимо
малы. Удобно использовать одноразовый шприц, в
который вместо иглы вставлен стеклянный
капилляр (например, от градусника). Наблюдать за
перемещающейся границей раздела жидкости и
насыщенного пара удобно в микроскоп с небольшим
увеличением. Для демонстрации в аудитории
наиболее удобна видеокамера. Измеряя скорость
перемещения границы, можно измерить коэффициент
диффузии по следующей рабочей формуле: