Продолжение. См. № 1, 3, 5, 7 /05
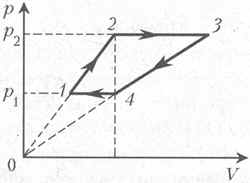
2 Над идеальным одноатомным газом постоянной массы проводят процесс, диаграмма которого изображена на рисунке. Найдите работу A, совершаемую газом в этом процессе, если на участке 2–3 газ получает количество теплоты Q23=200 Дж. Объём газа в точках 2 и 4 один и тот же, давление газа в точке 2 в два раза больше давления газа в точке 1.
Решение

Работа газа численно равна площади фигуры, которую ограничивает график процесса на плоскости переменных p и V (в данной задаче – площади трапеции):
![]()
Полученное газом количество теплоты
![]()
Из уравнений процессов 1–2 и 4–3 следует, что
![]()
![]()
Отсюда V2=2V1; V3=4V1. Используя эти соотношения, преобразуем выражения для работы газа и полученного им количества теплоты к виду:
![]()
![]()
из которого легко получить ![]()
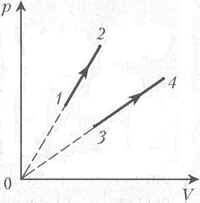
3 На рисунке изображены p, V – диаграммы двух процессов, проводимых над одним и тем же идеальным одноатомным газом. Масса газа, участвующего в процессе 1–2, в k=2 раза больше, чем масса газа, с которым проводится процесс 3–4. Температура в точке 1 равна температуре в точке 3, а температура в точке 2 равна температуре в точке 4. Найдите отношение n количеств теплоты, получаемых газом в процессах 1–2 и 3–4.
Решение
Для расчёта количества теплоты, полученного газом, воспользуемся первым законом термодинамики. Рассмотрим сначала процесс 1–2. Изменение внутренней энергии газа и работа, совершённая газом в этом процессе, соответственно равны:
![]()
![]()
Здесь n1 – число молей газа, участвующего в процессе 1–2; pi, Vi, Ti – давление, объём и температура газа в точке i (i =1, 2). Поскольку точки 1 и 2 лежат на прямой, проходящей через начало координат, справедливо равенство
![]()
Используя это равенство, а также уравнения состояния газа в точках 1 и 2:
![]()
![]()
выражение для работы газа легко преобразовать к виду:
![]()
Из первого закона термодинамики следует, что количество теплоты, полученное газом в процессе 1–2, равно
![]()
Рассуждая аналогично, находим количество теплоты, полученное газом в процессе 3–4:
![]()
где ![]() – количество газа, участвующего в этом
процессе. Поскольку, по условию задачи, T3=T1,
T4=T2, выражение для Q34
преобразуется к виду:
– количество газа, участвующего в этом
процессе. Поскольку, по условию задачи, T3=T1,
T4=T2, выражение для Q34
преобразуется к виду:
![]()
Тогда ![]()
4 В
теплоизолированном цилиндрическом сосуде под
поршнем массой m находится идеальный одноатомный
газ. Расстояние между поршнем и дном сосуда равно
x. На какое расстояние ![]() опустится поршень,
если сверху положить на него груз массой
опустится поршень,
если сверху положить на него груз массой ![]() ?
Считать, что
?
Считать, что ![]() начальное и конечное положения поршня
являются положениями равновесия, трение поршня о
стенки сосуда пренебрежимо мало. Атмосферное
давление не учитывать.
начальное и конечное положения поршня
являются положениями равновесия, трение поршня о
стенки сосуда пренебрежимо мало. Атмосферное
давление не учитывать.
Решение
Поскольку газ теплоизолирован, из
первого закона термодинамики следует, что ![]() где
где ![]() –
изменение внутренней энергии газа,
–
изменение внутренней энергии газа, ![]() – работа,
совершённая над газом. Для газа справедливо
также уравнение состояния (уравнение
Клапейрона–Менделеева):
– работа,
совершённая над газом. Для газа справедливо
также уравнение состояния (уравнение
Клапейрона–Менделеева):
![]()
Пусть p0, V0 и T0
– параметры начального состояния, а ![]()
![]() и
и ![]() – параметры
конечного состояния газа. Так как
– параметры
конечного состояния газа. Так как ![]() изменения
параметров состояния газа также малы:
изменения
параметров состояния газа также малы:
![]()
![]()
![]()
С точностью до малых первого порядка из уравнения Клапейрона–Менделеева получаем
![]()
Кроме того, с той же точностью имеем
![]()
Подставляя найденные выражения в
равенство ![]() получаем, что
получаем, что
![]()
Поскольку ![]() и
и ![]() получаем
получаем ![]()
5 Трубка поперечного сечения S, заполненная водяным паром под давлением p, запаяна с двух концов и расположена горизонтально. При этом находящийся в трубке поршень делит трубку на две равные части. Трубку ставят вертикально, в результате чего поршень смещается и объём под ним уменьшается в четыре раза. Найдите массу поршня m, если давление насыщенного водяного пара равно 2p. Трением и толщиной поршня пренебречь, температуру пара считать постоянной. Ускорение свободного падения g.
Решение
При перемещении поршня давление пара в нижней части трубки увеличится до величины 2p, после чего будет оставаться постоянным. При этом часть пара сконденсируется. Пар над поршнем можно считать идеальным газом. Его давление, согласно закону Бойля–Мариотта, равно
![]()
Из условия равновесия поршня имеем: p1S + mg = 2pS.
Объединяя записанные выражения, получаем: ![]()